기업
한국릴리, ‘마운자로’ 비만 수면무호흡증 "국내 승인"
바이오스펙테이터 이주연 기자
GLP-1/GIP ‘마운자로’, 중등도-중증 폐쇄성 수면무호흡증(OSA) 비만환자에 최초∙유일 치료제로 국내 승인..무호흡-저호흡 지수(AHI) 58.7%↓

한국릴리는 GLP-1/GIP 이중작용제 '마운자로(성분명: 터제파타이드)'가 국내 식품의약품안전처로부터 폐쇄성 수면무호흡증(obstructive sleep apnea, OSA) 치료제로 승인받았다고 21일 밝혔다.
마운자로는 기존 당뇨병 및 비만치료제로 승인받은 약물이며, 이번 승인으로 초기 체질량지수(BMI)가 30kg/m2 이상인 성인 비만환자에서 중등도에서 중증의 OSA 치료를 위한 저칼로리 식이요법 및 운동요법의 보조제로 사용할 수 있게 됐다.
한국릴리는 마운자로가 중등도에서 중증의 OSA 치료를 위해 허가된 최초이자 현재까지 유일한 치료제라고 강조했다. 수면무호흡증 중 가장 흔한 유형인 OSA는 상기도가 좁아져 공기가 기도를 통과하지 못해 수면중 호흡이 감소하거나 중단되는 질환이다.
OSA를 치료하지 않으면 낮에 졸린 ‘주간 기면’ 증상이 나타나거나 식사, 대화, 운전 등 일상 수행 능력이 감소하고, 심한 경우 인지장애가 발생할 수 있다. 또한 OSA는 고혈압, 부정맥, 관상동맥 질환, 뇌졸중, 심장대사 질환 및 제2형 당뇨병 등 심각한 합병증을 유발하며 환자 삶의 질 저하에도 영향을 미칠 수 있다.
국내 수면무호흡증 환자는 지난 2020년 약 9만명에서 지난해 약 18만명으로 지난 5년간 두배로 증가했다. 회사에 따르면 중등도에서 중증 OSA 환자 중 최대 80%가 진단되지 않은 것으로 추정되는 만큼, 실제 환자규모는 더 클 것으로 예상된다.
OSA 환자의 경우 대부분 양압기(positive airway pressure, PAP) 치료를 받고 있지만 착용 불편감, 소음 등의 이유로 치료 순응도가 낮아 미충족 수요가 존재한다.
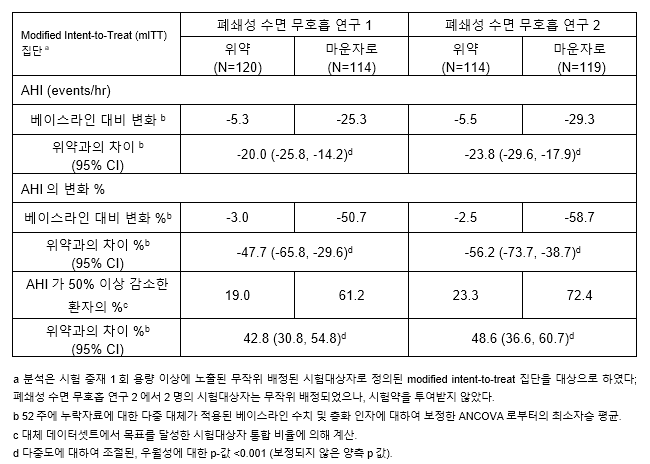
이번 승인확대는 SURMOUNT-OSA 임상3상 두가지를 기반으로 이뤄졌다. 성인 비만(BMI 30kg/m2 이상)환자 중 중등도에서 중증의 OSA를 갖는 환자 469명을 대상으로, 위약대비 마운자로의 최대내약용량(10mg 또는 15mg)의 임상적 유효성 및 안전성을 평가했다. 1차종결점은 52주차(1년)의 무호흡-저호흡 지수(apnea-hypopnea index, AHI)의 투여전(baseline) 대비 변화였다.
임상결과 마운자로는 투여전보다 AHI를 최대 58.7% 감소시켜 위약군(최대 -2.5%) 보다 통계적으로 유의미한 개선을 보였다. 마운자로 투여군은 AHI를 시간당 평균 25.3~29.3회 줄였지만, 위약 투여군은 5.3~5.5회 줄이는 데 그쳤다.
특히 마운자로 투여군은 최대 72.4%의 환자가 AHI 50% 이상 감소를 달성한 것으로 확인됐다. AHI의 50% 이상 감소는 통상적으로 OSA 수술의 성공여부를 판단하는 기준이다. 위약투여군은 양압기(PAP) 치료를 받더라도 AHI 50% 이상 감소를 달성한 환자비율이 23.3%였다.
또한 마운자로 투여군에서 OSA 관해 또는 경도의 무증상 OSA를 달성한 비율이 위약투여군보다 높게 나타났다. 마운자로 투여 환자 중 약 절반(임상1: 42.2%, 임상2: 50.2%)은 OSA의 관해 또는 경도의 무증상 OSA를 달성해, 위약투여군(임상1: 15.9%, 임상2: 14.3%) 대비 유의미하게 개선한 것으로 확인됐다. 추가로 마운자로 투여군의 투여전 대비 체중감소율은 임상1과 임상2에서 각각 17.1%, 19.6%로 나타났다.
마운자로의 안전성 프로파일은 이전의 SURMOUNT 및 SURPASS 임상결과와 유사했다고 회사는 설명했다. 가장 흔하게 나타난 이상반응은 위장관련 이상반응으로 대부분 경증 또는 중등도 수준이었고, 위약대비 가장 자주 나타난 이상반응은 설사, 메스꺼움, 변비, 구토 등이었다.
류사기(Stacie Siqi Liu) 한국릴리 심혈관대사건강사업부 전무는 “많은 국내 OSA 환자들은 질환에 대한 낮은 인식이나 치료에 대한 미충족 수요 등으로 인해 일상생활에 장애를 겪는 것은 물론, 여러 동반질환으로 인해 심각한 건강문제에 노출되어 있다”며 “한국릴리는 중등도에서 중증의 OSA에서 의미있는 개선을 확인한 최초의 치료제로서 마운자로가 국내 환자들의 복합적인 건강문제를 해결하는 데 중요하게 기여할 수 있도록 최선을 다할 것이다”고 말했다.













![[인사]메디톡스 그룹, 2026년 임원 승진인사](https://img.etoday.co.kr/crop/77/77/2303220.jpg)




