BioS+
[이종혁 교수의 약가협상]⑦호주의 보험약가제도
바이오스펙테이터 천승현 기자
가. 신약의 등재절차
신약이 급여되기 위해서는 PBS(Pharmaceutical Benefits Scheme)에 등재되어야 하는데, 약제급여자문위원회(Pharmaceutical Benefits Advisory Committee, 이하 PBAC)의 검토 후 급여추천을 받은 의약품에 대하여 보건부(Department of Health and Ageing, DHA)에서 최종적으로 약가를 결정한다. PBAC는 산하에 비용효과성 평가를 자문하는 ESC(The Economics Sub-Committee)와 의약품 사용현황 등을 모니터링하는 DUSC(The Drug Utilization Sub-Committee)를 운영하며, 1년에 3회(4월, 8월, 12월)위원회가 개최된다. 의약품의 급여신청은 유형에 따라서 4가지 유형으로 나뉘고, 신약이나 새로운 적응증을 추가한 의약품 등의 경제성평가가 필요한 의약품은 Major신청에 해당된다.
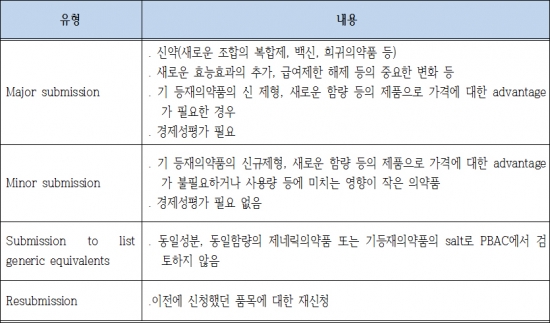
▲호주의 의약품 급여신청 유형{자료 : Guidelines for preparing submission to the PBAC (PBAC, July, 2015)}
급여신청된 자료는 PBAC에서 검토하고, ESC에서는 비용효과성 등의 경제성평가와 관련된 내용을 논의하고, DUSC에서는 예상사용량, 재정영향 등에 대하여 논의하여 그 결과를 제약사에 통보한다. 제약사는 이에 대하여 소명자료를 제출할 수 있다. 이후 PBAC회의에서 최종 급여여부에 대한 권고가 결정되는데, 필요시 제약사는 회의에 참석하여 제품의 임상적 유용성, 비용효과성 등에 대하여 설명할 수 있다. 최종적으로 PBAC위원들 간의 토론 후 다수결로 급여여부에 대한 권고를 결정하고, 그 결과는 3일내에 제약사에 구두 통보된다. PBAC에서 급여권고된 약제는 필요시 가격협상, 위험분담계약 등을 거쳐 PBS에 등재되며, 급여목록은 Formulary 1(F1)과 Formulary 2(F2)로 나뉜다.
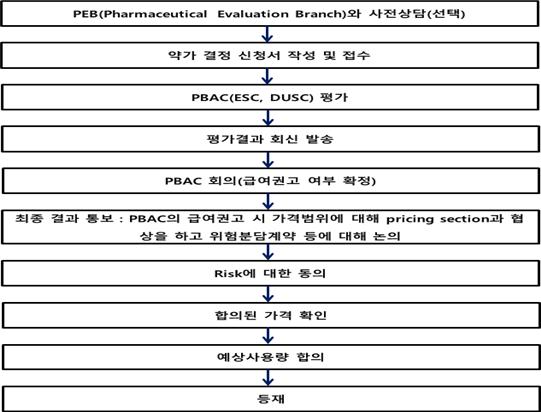
▲호주의 PBS 급여 등재절차{자료 : Guidelines for preparing submission to the PBAC (July, 2015)} ... <계속>



















