기업
이엔셀, ‘MSC세포’ CMT 1b/2a상 “IND 변경신청”
바이오스펙테이터 신창민 기자
진행중인 1b상에 2a상 통합토록 변경신청, 1b상 최근 환자투여 완료

이엔셀(ENCell)은 18일 중간엽줄기세포(MSC) 치료제 후보물질 ‘EN001’의 샤르코-마리-투스병(Charcot-Marie-Tooth disease, CMT) 1A형 환자 대상으로 식품의약품안전처에 임상1b/2a상 변경신청을 완료했다고 밝혔다.
이엔셀은 이번 임상시험계획(IND) 변경신청을 통해, 기존에 진행해오던 임상1b상에 새로운 2a상 파트를 추가할 계획이다.
이엔셀은 이번 통합임상을 통해 1b상에서는 EN001 반복투여의 안전성 및 내약성에 근거한 최대내약용량(MTD), 임상2a상 권장용량(RP2D)을 결정한다. 2a상에서는 기준선(visit 2) 대비 24주시점의 CMT 신경병척도(charcot-marie-tooth neuropathy scale version 2, CMTNSv2)의 변화량을 통해 위약 대비 EN001의 유효성을 평가할 계획이다.
이엔셀이 EN001로 진행중인 1b상은 CMT 1A형 환자에게 EN001 반복투여에 따른 안전성 및 유효성 평가를 위해 디자인했다. 최병옥 삼성서울병원 신경과 교수가 임상시험책임자이다. 회사는 1b상에서 3명의 저용량군(1.25×10^6cells/kg)을 대상으로 안전성을 확인한 이후, 지난해 12월 2배 더 높은 고용량군(2.5×10^6cells/kg)을 대상으로 투여를 시작했다. 이엔셀은 최근 3명의 고용량군 환자에 대한 투여를 완료했으며 안전성 및 내약성, 탐색적 효능지표 결과를 확인했다.
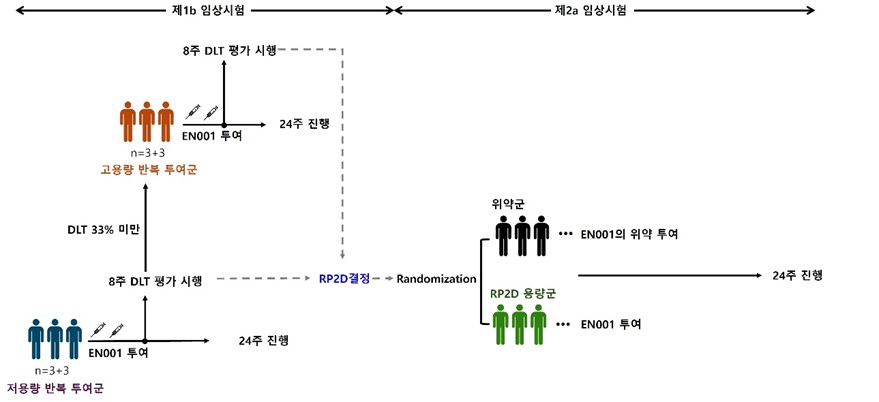
▲이엔셀 임상1b/2a상 개요(회사 제공)






![[인사]셀트리온그룹 2026년 임원승진 인사](https://img.etoday.co.kr/crop/74/74/2274343.jpg)






![[인사]셀트리온그룹 2026년 임원승진 인사](https://img.etoday.co.kr/crop/77/77/2274343.jpg)





