오피니언
2025년 FDA ‘신약승인 56건’서 본 “4가지 톱픽은?”
바이오스펙테이터 신창민 기자
CDER 46건, CBER 10건 승인, 작년 FDA 규제 불확실성속 2024년과 ‘승인신약 수 유사’..항암제서 알테오젠 rHuPH20 적용 ‘키트루다SC’ 승인, ‘폐암’ HER2 저해제 출시도..희귀질환 신약 개수 항암제 이어 2위, 수십년만에 新계열약 “진전” 등
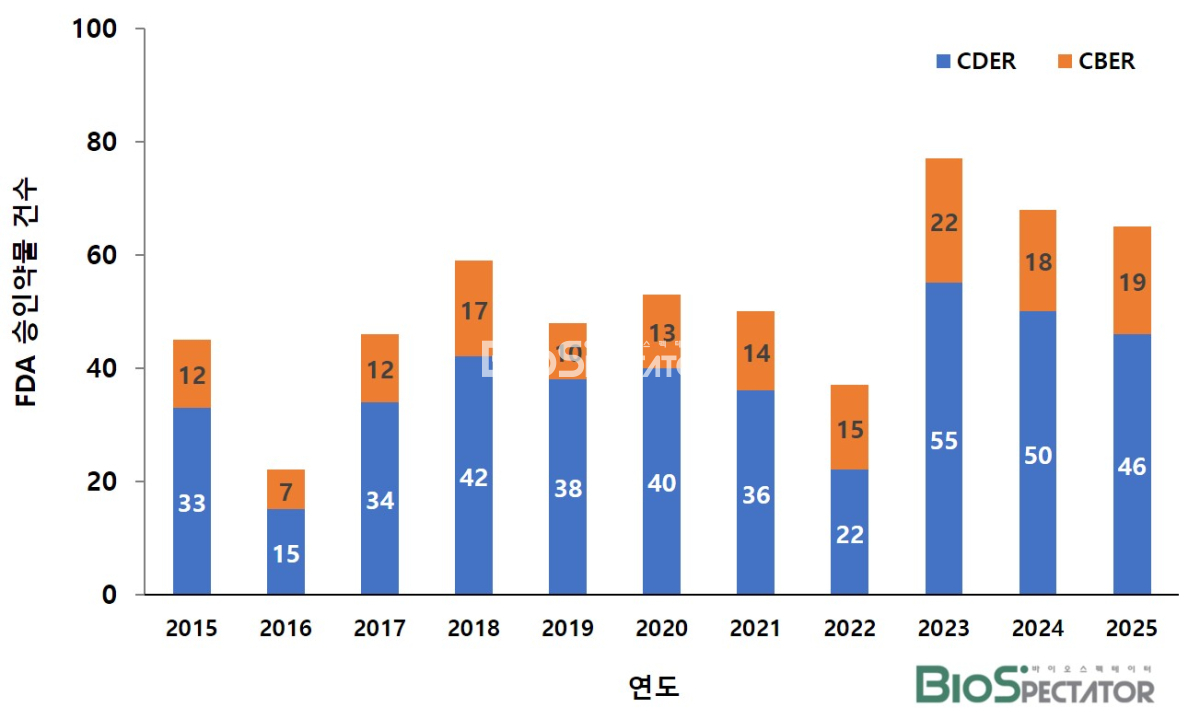
▲지난 11년간 FDA 승인약물 건수(진단제품 포함)
미국 식품의약국(FDA)이 지난 2025년 승인한 신약은 총 56건으로 집계됐다. 이 중 약물평가연구센터(CDER)가 승인한 약물은 46건, 바이오의약품평가연구센터(CBER)가 승인한 치료제는 10건이었다. 단, 진단용 시약 제품까지 포함할 경우, CBER이 19건으로 늘어나며 총 65건이었다. 이는 지난 2024년 FDA가 승인한 신약 개수인 68건과 비교해 유사한 수준이다.
지난해에는 미국 보건복지부(HHS) 및 FDA의 연이은 구조조정과 고위급 책임자가 변경되는 등, 신약 허가검토에 대한 FDA의 역량에 대한 우려가 이어졌다. 특히 백신과 가속승인에 비판적인 입장을 취해온 비나이 프라사드(Vinay Prasad) 박사가 CBER 소장으로 취임하면서 업계의 우려감은 더욱 고조됐다.
그러나 일단은 지난 2024년과 비교해 승인된 신약 개수에서 큰 차이를 보이지는 않았다. 또한 FDA가 엄격한 입장을 취해온 세포유전자치료제 및 백신에서도, 지난해와 2024년 승인된 약물이 각각 9건으로 동일한 수로 집계됐다.
진단제품을 제외하고, 지난해 승인된 약물 56건 중 희귀 양성종양을 포함한 항암제가 17건(30.4%)으로 가장 많은 비율을 차지했다. 특히 희귀질환 분야에서 14건(25%)의 신약이 승인되며 항암제 다음으로 큰 비중을 차지했다. 지난해 항암제 분야에서는 국내 알테오젠(Alteogen)의 히알루로니다제 피하주사(SC) 제형기술이 적용된 미국 머크(MSD)의 ‘키트루다 큐렉스(Keytruda Qlex)’가 FDA 승인을 받으며 업계의 이목을 끌었다. 또한 독성으로 인한 개발 어려움을 딛고, 폐암에서 경구용 HER2 저해제도 시장에 나왔다.... <계속>


















